Wat maakt metalen zo veelzijdig en onmisbaar in de techniek? Dit artikel verkent de essentiële basisprincipes van kristallisatie, structuur en transformaties van metalen. Ontdek hoe metalen overgaan van vloeibare naar vaste toestand, het belang van kristalfouten en het fascinerende fenomeen van superafkoeling. Door deze principes te begrijpen, krijg je inzicht in metaaleigenschappen en hun toepassingen in verschillende industrieën.
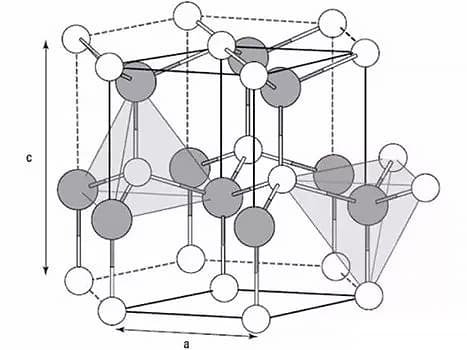
Metalen zijn kristallen in vaste toestand.
De kristalstructuur is gerelateerd aan de eigenschappen, plastische vervorming en warmtebehandelingsfasetransformaties van metalen.
De drie meest voorkomende roosters in metalen zijn het lichaamsgecentreerde kubische rooster, het gezichtsgecentreerde kubische rooster en het dicht opeengepakte hexagonale rooster.
Kristalafwijkingen kunnen worden ingedeeld in drie categorieën op basis van hun geometrische vormen: puntafwijkingen, lijnafwijkingen en vlakke afwijkingen.
Het proces waarbij een metaal overgaat van een vloeibare naar een vaste (kristallijne) toestand staat bekend als metaalkristallisatie.
(1) Afkoelingscurve en het fenomeen superkoeling
De afkoelcurve is een grafiek die het verband weergeeft tussen temperatuur en tijd tijdens het afkoelingsproces van een materiaal. De afkoelcurve van een metaalkristal kan worden bepaald met thermische analysemethoden. Het proces omvat het smelten van het metaal om een zo gelijkmatig mogelijke temperatuur te bereiken, het afkoelen met een bepaalde snelheid, het registreren van de temperatuurveranderingen in de tijd en het plotten van de gegevens op een temperatuur-tijdgrafiek om de afkoelingscurve te verkrijgen, zoals weergegeven in figuur 1.
De latente kristallisatiewarmte die vrijkomt tijdens de kristallisatie compenseert het warmteverlies van het metaal naar buiten, waardoor er een horizontale lijn verschijnt op de afkoelcurve. De temperatuur die overeenkomt met deze lijn is de werkelijke kristallisatietemperatuur van het metaal.
Experimenten tonen aan dat de werkelijke kristallisatietemperatuur (T1) van het metaal altijd lager is dan de theoretische kristallisatietemperatuur (T0). Dit fenomeen wordt superkoeling genoemd. Onderkoeling is een vereiste voor kristallisatie. Het verschil tussen T0 en T1, △T = T0 - T1, staat bekend als de superkoelingsgraad.
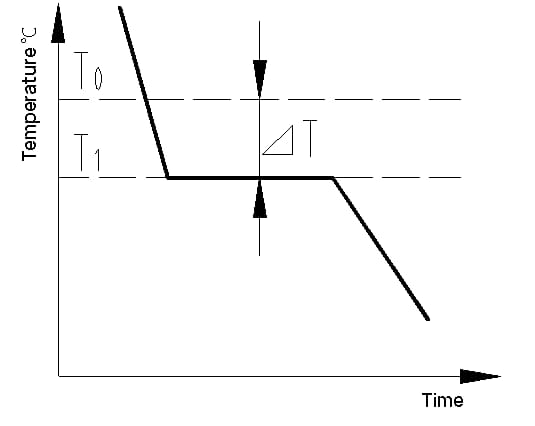
Fig. 1 Afkoelingscurve van zuiver ijzerkristal
(2) Kristallisatieproces
Het kristallisatieproces omvat de creatie en expansie van kernen. Dit proces staat bekend als nucleatie en groei.
Het fenomeen waarbij een metaal van de ene roosterstructuur naar de andere overgaat als de temperatuur in de vaste toestand verandert, staat bekend als een isomorfe transformatie.
Enkele metalen die deze transformatie vertonen zijn ijzer, kobalt, titaniumtin en mangaan.
Kristallen van hetzelfde metaalelement die bestaan in verschillende roostervormen worden allotrope kristallen van het metaal genoemd.
Fase: Verwijst naar de uniforme componenten binnen een legering (of zuiver metaal) die dezelfde samenstelling, structuur en eigenschappen hebben en van elkaar gescheiden zijn door een interface.
De fasestructuur in legeringen kan worden verdeeld in twee typen op basis van de interactie tussen de samenstellende elementen: vaste oplossing en metaalverbinding.
(1) Vaste oplossing: Wanneer de vloeibare legering stolt, kunnen de elementen nog steeds in elkaar oplossen om een fase te vormen waarin atomen van het ene element verspreid zijn over het rooster van een ander element. Deze fase staat bekend als een vaste oplossing.
(2) Metaalverbinding.
Het fasediagram van een legering, ook wel evenwichtsdiagram van een legering of toestandsdiagram van een legering genoemd, is een diagram dat de relatie weergeeft tussen de temperatuur, samenstelling en toestand van een legering onder evenwichtsomstandigheden. Het toont de structurele veranderingswetten van legeringen met verschillende samenstellingen als ze langzaam worden afgekoeld of verwarmd tot het oneindige.
Het fasediagram van een legering is een belangrijk hulpmiddel bij het kiezen van de juiste samenstelling van de legering, het analyseren van de microstructuur van de legering, het bestuderen van de eigenschappen en het bepalen van giet-, smeed- en warmtebehandelingsprocessen.
(1) Homogeen fasediagram: Dit type diagram stelt een legeringssysteem voor waarbij twee componenten oneindig mengbaar zijn in zowel de vloeibare als de vaste fase. Tijdens het stollen vormt de legering een vaste oplossing uit de vloeibare fase, een proces dat bekend staat als homogene transformatie.
(2) Eutectisch fasediagram: In dit diagram zijn twee componenten volledig mengbaar in vloeibare toestand en hebben ze een eutectische transformatie. Eutectische transformatie verwijst naar de gelijktijdige kristallisatie van twee vaste fasen met een specifieke samenstelling uit een uniforme vloeibare fase met een specifieke samenstelling bij een bepaalde temperatuur.
(3) Peritectisch fasediagram: In dit diagram zijn twee componenten oneindig mengbaar in vloeibare toestand en vormen ze een eindige vaste oplossing in vaste toestand. Er is ook een toestand van peritectische transformatie. Peritectische transformatie verwijst naar de reactie tussen de vloeibare fase van een bepaalde component en de vaste fase van een andere component, die resulteert in de vorming van een nieuwe vaste fase bij constante temperatuur.

Staal is een ijzer-koolstoflegering met een specifieke samenstelling.
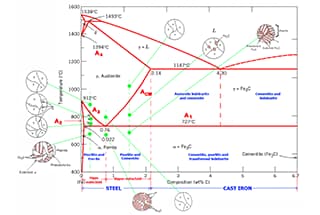
Het fasediagram van ijzer-koolstoflegeringen illustreert de verschillende evenwichtsstructuren van ijzer-koolstoflegeringen met verschillende samenstellingen bij verschillende temperaturen, zoals weergegeven in het Fe-Fe3C fasediagram.
Uit het Fe-Fe3C fasediagram kunnen we de temperatuur bepalen waarbij de fasetransformatie optreedt in een ijzer-koolstoflegering van een bepaalde samenstelling, ook wel het kritieke punt genoemd.
Door het Fe-Fe3C fasediagram te analyseren, is het mogelijk om het fasetransformatieproces in verschillende temperatuurgebieden en de potentiële evenwichtsstructuur bij afkoeling tot kamertemperatuur te voorspellen.
Raadpleeg de karakteristieke punten in het Fe-Fe3C fasediagram voor een beschrijving van elk punt in het fasediagram van de ijzer-koolstoflegering en de karakteristieke lijnen voor een beschrijving van elke lijn.
Volgens het fasediagram van ijzer-koolstoflegeringen is koolstofstaal met koolstofgehalte minder dan 2.11% en gietijzer met een koolstofgehalte van meer dan 2.11% worden onderscheiden.
Op basis van structurele eigenschappen wordt de ijzer-koolstoflegering onderverdeeld in zeven categorieën op basis van het koolstofgehalte in het fasediagram van de ijzer-koolstoflegering:
(1) Industrieel zuiver ijzer, met koolstofgehalte < 0,0218%;
(2) Eutectoid staal, met koolstofgehalte 0,77%;
(3) Hypoeutectoïde staal, met een koolstofgehalte variërend van 0,0218% tot 0,77%;
(4) Hypereutectoïde staal, met een koolstofgehalte variërend van 0,77% tot 2,11%;
(5) Eutectisch wit gietijzer, met koolstofgehalte 4.30%;
(6) Subkristallijn wit gietijzer, met een koolstofgehalte variërend van 2.11% tot 4.30%;
(7) Superkristallijn wit gietijzer, met een koolstofgehalte variërend van 4,30% tot 6,69%.
Metaal: Een materiaal met een goede thermische en elektrische geleidbaarheid, gekenmerkt door zijn ondoorzichtige uiterlijk en metaalglans. De geleidbaarheid van metalen neemt af als de temperatuur stijgt en ze staan bekend om hun vervormbaarheid en uitzetbaarheid.
Een metaalkristal is een vaste stof waarin atomen in een regelmatig patroon zijn gerangschikt.
Legering: Een stof met metaalachtige eigenschappen samengesteld uit twee of meer elementen, waaronder metalen en niet-metalen.
Versterking van de vaste oplossing: Dit gebeurt wanneer atomen van de opgeloste stof de ruimten of tussenruimten van het rooster van het oplosmiddel bezetten, waardoor het rooster vervormd raakt en de sterkte van de vaste oplossing toeneemt. hardheid en sterkte van de vaste oplossing.
Samenstelling: Een nieuwe kristallijne vaste structuur met metaaleigenschappen wordt gevormd door de combinatie van legeringscomponenten.
Mechanisch Mengsel: Een samenstelling van een legering die bestaat uit twee verschillende kristalstructuren, ook al lijkt het één geheel met onafhankelijke mechanische eigenschappen.
Ferriet: Een interstitiële vaste oplossing van koolstof in alfa-Fe (lichaam-gecentreerd kubisch ijzer).
Austeniet: Een interstitiële vaste oplossing van koolstof in gamma-Fe (face centered cubic iron).
Cementiet: Een stabiele verbinding (Fe3C) gevormd door de combinatie van koolstof en ijzer.
Pareliet: Een mechanisch mengsel samengesteld uit ferriet en cementiet (F + Fe3C, met 0,8% koolstof).
Ledeburiet: Een mechanisch mengsel bestaande uit cementiet en austeniet (met 4,3% koolstof).

Warmtebehandeling van metalen is een cruciaal proces bij mechanische productie. In tegenstelling tot andere verwerkingsmethoden verandert warmtebehandeling de vorm of de algemene chemische samenstelling van het werkstuk niet, maar verbetert het de prestaties door de microstructuur of de chemische samenstelling van het oppervlak te wijzigen.
Het doel van warmtebehandeling is het verbeteren van de interne kwaliteit van het werkstuk, die vaak niet zichtbaar is met het blote oog. Om de gewenste mechanische, fysische en chemische eigenschappen van een metalen werkstuk te bereiken, is warmtebehandeling vaak nodig naast de juiste selectie van materialen en verschillende soorten materiaal. vormprocessen.
Staal is het meest gebruikte materiaal in de mechanische industrie en de microstructuur kan worden gecontroleerd door middel van warmtebehandeling. Warmtebehandeling van staal is dan ook een belangrijk aspect van metaalwarmtebehandeling.
Behalve staal kan warmtebehandeling ook worden gebruikt om de mechanische, fysische en chemische eigenschappen van aluminium, koper, magnesium, titanium en hun legeringen te wijzigen, zodat verschillende eigenschappen kunnen worden bereikt.